Materi.Co.ID – Hay hay bertemu lagi dengan artikel materi.co.id . Kali ini kita akan membahas tentang asam basa. Simak ulasan lengkap nya dibawah ini.
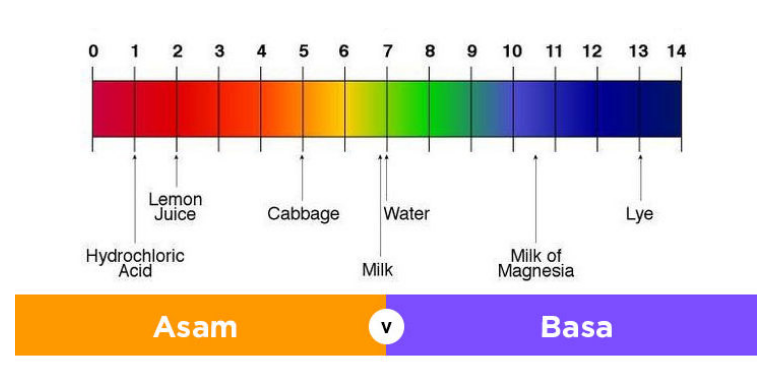
Pengertian Asam Basa
Kata asam berasal dari bahasa Latin yakni acidus yang berarti masam. Asam merupakan suatu zat senyawa yang membuat rasa masam. Basa ialah suatu zat senyawa yang bereaksi pada asam.
Menciptakan suatu senyawa dinamai sebagai garam, jika basa ialah zat-zat yang dapat menetralkan rasa asam. Secara kimia, asam dan basa saling berlawanan. Sifat pada basa biasanya dapat dilihat pada rasa pahit atau licin.
Asam dan basa sangat erat sekali pada kehidupan kita, pada tubuh manusia didalamnya terdapat keseimbangan asam basa dalam beradaptasi serta menjaga fungsi dalam tubuh secara baik.
Contohnya seperti asam lambung yang bisa membunuh mikroorganisme yang berasal dari makanan yang dikonsumsi. Apabila pada kehidupan sehari-hari contoh asam basa yakni, asam cuka, minuman bersoda, jeruk, aki bersifat asam. Namun untuk sabun dan bahan pupuk lainnya dinamai sebagai basa.
Teori Asam Basa Arrhenius
Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, Pengertian dari asam dan basa, yaitu:
- asam ialah senyawa yang apabila dilarutkan dalam air melepaskan ion H+.
- basa ialah senyawa yang apabila dilarutkan dalam air melepaskan ion OH−.
Gas asam klorida (HCl) yang sangat larut dalam air termasuk asam Arrhenius, sebagaimana HCl dapat terurai menjadi ion H+dan Cl− di dalam air. Berbeda halnya dengan metana (CH4) yang bukan asam Arrhenius sebab tidak bisa menghasilkan ion H+ dalam air walaupun memiliki atom H. Natrium hidroksida (NaOH) termasuk basa Arrhenius, sebagaimana NaOH yaitu senyawa ionik yang terdisosiasi menjadi ion Na+ dan OH− ketika dilarutkan dalam air. Konsep asam dan basa Arrhenius ini terbatas pada keadaan air sebagai pelarut.
Teori Asam Basa Bronsted – Lowry
Teori Asam Basa Bronsted dan Lowry ini merupakan sebuah Teori yang melengkapi kekurangan dari Teori Asam dan Basa Arrhenius sebab tak semua Senyawa itu bersifat Asam ataupun Basa bisa menciptakan sebuah Ion H+ atau OH- apabila dilarutkan didalam Air.
Teori Asam Basa Menurut Bronsted – Lowry bahwa Asam yakni Senyawa yang dapat menyumbang proton yakni Ion H+ ke Senyawa atau Zat Lain. Sementara basa ialah Senyawa yg bisa menerima Proton, yakni Ion H+ dari senyawa ataupun zat Lain. Selanjutnya menurut Johannes Nicolaus Bronsted dan Thomas Martin Lowry bahwa Zat sanggup berperan baik sebagai Asam ataupun Basa, apabila zat tertentu lebih mudah melepas proton dan zat tersebut akan berperan sebagai asam dan lawannya berperan sebagai basa.
Sebaliknya apabila suatu zat lebih mudah menerima Proton maka zat tersebut akan berperan sebagai basa dan dalam suatu larutan asam dalam Air, Air tersebut memiliki peran sebagai Basa. Akan tetapi didalam Teori Asam – Basa Bronsted Lowry ini mempuyai kelemahan yakni tak bisa memperlihatkan Sifat Asam maupun Sifat Basa suatu senyawa jika tidak terdapat proton yang ikut serta didalam Reaksi.
Teori Asam Basa Lewis
Menurut Gilbert Newton Lewis bahwa Teori Asam – Basa merupakan masalah dasar yg harus diselesaikan dengan landasan teori struktur Atom, dan bukanlah berdasarkan oleh hasil percobaan.
Adapun Teori Asam Basa Menurut Lewis bahwa Asam yaitu zat yang bisa menerima elektron dan menurut Lewis bahwa Basa yakni zat yang bisa mendonorkan Pasangan Elektron. Semua Zat yg didefinisikan sebagai Asam didalam Teori Asam – Basa Arrhenius juga termasuk asam di dalam Kerangka Teori Lewis ini sebab Proton ialah Aksepator Pasangan Elektron dan didalam Reaksi Netralis Proton bisa membangun ikatan koordinat dengan Ion Hidroksida.
Reaksi Asam Basa
Reaksi asam basa atau reaksi penetralan merupakan reaksi zat yang melepaskan ion H+ dan basa ialah zat yang melepaskan ion OH–. Selanjutnya akan membentuk air (H2O) yang sifatnya netral.
- Asam Arrhenius ialah zat yang dilarutkan kedalam air dalam membentuk ion hidrogen (H+), yakni asam yang menambah konsentrasi pada ion H+ kedalam larutan air. Reaksi protonasi air akan menciptakan sebuah ion hidronium (H3O+): H+ + H2O > H3O+
- Asam kuat atau asam klorida ialah zat yang dilarutkan kedalam air menurut persamaan: HCl + H2O > H3O+ + Cl-, yakni semua molekul pada HCl akan memberi salah satu ion hidrogen pada larutan.
- Asam lemah atau asam asetat hanya dilarutkan sebagian kedalam air menurut persamaan: HCH3OO + H2O > H3O+ + CH3OO-. Pada asam lemah, tingginya larutan umumnya kurang dari 1%, yaitu hanya 1 pada 100 molekul asam asetat yang terlarut, sisanya yang tertinggal berupa molekul HCH3OO pada larutan.
- Basa Arrhenius ialah suatu zat yang dilarutkan kedalam air dengan membentuk ion hidroksida (OH-), yaitu basa yang akan menambah konsentrasi pada ion OH- pada larutan berair.
- Basa kuat, misalnya natrium hidroksida, dilarutkan kedalam air menurut persamaan: NaOH > Na+ + OH-.
- Basa lemah, misalnya larutan amoniak, hanya sebagian yang terlarut kedalam air menurut persamaan: NH3 + H2O > NH4+ + OH-. Pada asam lemah, tingginya pelarut biasanya kurang dari 1%, yaitu hanya 1 pada 100 molekul amoniak yang bereaksi pada air, sisanya yang tertinggal yakni berupa molekul NH3 pada larutan.
Indikator Asam Basa
Indikator asam basa merupakan petunjuk tentang derajat keasaman suatu larutan berdasarkan perubahan warna indikator akibat perubahan pH larutan. Indikator asam basa umumnya merupakan asam atau basa organik lemah. Senyawa indikator yang tak terdisosiasi akan memiliki warna berbeda dibanding dengan indikator yang terionisasi. Sebuah indikator asam basa tidak akan mengubah warna dari larutan murni asam ke murni basa pada konsentrasi ion hidrogen yang spesifik, melainkan hanya pada kisaran konsentrasi ion hidrogen. Kisaran ini termasuk suatu interval perubahan warna, yang dinaami rentang/trayek pH.
Contoh indikator yang sering digunakan adalah kertas lakmus dan larutan indikator.
A.Indikator Tunggal
Indikator tunggal hanya bisa membedakan larutan bersifat asam atau basa, namun tidak bisa menentukan harga pH dan pOH. Yang termasuk dalam indikator tunggal adalah :
- Lakmus merah dan biru
Lakmus merah : berwarna merah dalam larutan asam, dan akan berubah warna menjadi biru apabila dicelupkan ke dalam larutan basa.
Lakmus biru : berwarna biru dalam larutan basa, dan akan berubah warna menjadi merah bila dicelupkan ke dalam larutan asam.
Lakmus biru (kiri) dan merah (kanan) : Lakmus biru dicelupkan ke dalam larutan asam (kiri), lakmus merah dicelupkan ke dalam larutan basa (kanan).
- Fenolftalein
Fenolftalein merupakan salah satu indikator asam – basa sintetik yang mempunyai rentang pH antara 8,00 – 10,0. Pada larutan asam dan netral, fenolftalein tidak berwarna. Sementara bila dimasukkan ke dalam larutan basa, warnanya akan berubah menjadi merah.
- Metil jingga
Larutan metil jingga bisa membedakan antara larutan asam dengan larutan netral. Larutan asam yang ditetesi metil merah akan tetap berwarna merah, sementara larutan netral berwarna kuning. Namun, metil jingga juga akan mengakibatkan larutan basa berwarna kuning, Berarti, untuk mengetahui apakah suatu larutan bersifat basa atau netral kita tidak bisa menggunakan metil jingga.
- Metil merah
Larutan metil merah sama dengan larutan metil jingga
Bromtimol biru di dalam larutan asam akan berwarna kuning, dalam larutan basa akan berwarna biru, serta di dalam larutan netral akan berwarna biru kekuningan.
Demikianlah bahasan kita mengenai asam basa. Terima kasih bagi yang menyempatkan waktu untuk membaca dan mampir di artikel √ Asam Basa : Pengertian, Teori, Reaksi & Indikatornya Lengkap. Semoga bermanfaat dan menambah wawasan kamu ?
Baca Juga Artikel Lainnya
- √ Asam Nukleat : Pengertian, Fungsi, Struktur, Sifat & Jenisnya Lengkap
- √ Asam Absisat : Pengertian, Fungsi & Cara Kerjanya Lengkap
- √ Asam Asetat : Pengertian, Fungsi, Sifat, Bahaya & Pembentukannya Lengkap
- √ Asam Amino : Pengertian, Jenis, Struktur & Sifatnya Lengkap
- √ Asam Sulfat : Pengertian, Sifat, Reaksi & Kegunaannya Lengkap