Materi.Co.ID – Hay hay bertemu lagi dengan artikel materi.co.id . Kali ini kita akan membahas tentang termodinamika. Simak ulasan lengkap nya dibawah ini.
Pengertian Termodinamika
Termodinamika merupakan fisika energi, panas, kerja, entropi dan kespontanan proses. Termodinamika berkaitan erat dengan mekanika statistik dimana hubungan termodinamika berasal.
Pada sistem tempat berlangsungnya proses perubahan wujud atau pertukaran energi, termodinamika klasik tidak berkaitan dengan kinetika reaksi (kecepatan suatu proses reaksi berlangsung). Oleh sebab itu, penggunaan istilah “termodinamika” umumnya merujuk pada termodinamika setimbang, yang mana konsep utamanya ialah proses kuasistatik, yang diidealkan. Sedangkan, termodinamika bergantung-waktu ialah termodinamika tak-setimbang.
Sebab termodinamika tidak berkaitan dengan konsep waktu, sudah dianjurkan bahwa termodinamika setimbang seharusnya disebut termostatik.
Hukum termodinamika kebenarannya sangat umum, dan hukum-hukum ini tidak sesuai kepada rincian dari interaksi atau sistem yang diteliti. Ini berarti mereka bisa diterapkan ke sistem dimana seseorang tidak tahu apa pun kecuali perimbangan transfer energi dan wujud diantara mereka dan lingkungan. Misalnya termasuk perkiraan Einstein tentang emisi spontan dalam abad ke-20 dan riset sekarang ini tentang termodinamika benda hitam.
Sistem Termodinamika
Klasifikasi sistem termodinamika berdasarkan sifat dari batasan dan arus benda, energi dan materi yang melaluinya terbagi menjadi 3 jenis sistem. berdasarkan jenis pertukaran yang berlangsung antara sistem serta lingkungannya, yakni :
1. Sistem Terbuka
Sistem yang menyebabkan berlangsungnya pertukaran energi (panas dan kerja) dan benda (materi) dengan lingkungannya. Sistem terbuka ini mencakup peralatan yang mengaitkan adanya aliran massa kedalam atau keluar sistem seperti pada kompresor, turbin, nozel dan motor bakar.
Sistem mesin motor bakar ialah ruang didalam silinder mesin, dimana campuran bahan bahan bakar dan udara masuk kedalam silinder, dan gas buang keluar sistem. Pada sistem terbuka ini, baik massa maupun energi bisa melintasi batas sistem yang memiliki sifat permeabel. Dengan begitu, pada sistem ini volume dari sistem tidak berubah maka dnamai dengan control volume.
Kesepakatan yang digunakan untuk menganalisis sistem disini yakni :
- Untuk panas (Q) yang bernilai positif jika diberikan kepada sistem dan bernilai negatif jika keluar dari sistem
- Untuk usaha (W) yang bernilai positif jika keluar dari sistem serta bernilai negatif jika diberikan (masuk) kedalam sistem.
2. Sistem Tertutup
Sistem yang menyebabkan berlangsungnya pertukaran energi (panas dan kerja) namun tidak terjadi pertukaran zat dengan lingkungan. Sistem tertutup terdiri dari suatu jumlah massa yang tertentu dimana massa ini tidak bisa melintasi lapis batas sistem. Namun, energi baik dalam bentuk panas (heat) maupun usaha (work) bisa melintasi lapis batas sistem tersebut.
Dalam sistem tertutup, walaupun massa tidak bisa berubah selama proses berlangsung, akan tetapi volume dapat saja berubah diakibatkan adanya lapis batas yang dapat bergerak (moving boundary) pada salah satu bagian dari lapis batas sistem tersebut. Contoh sistem tertutup ialah suatu balon udara yang dipanaskan, dimana massa udara didalam balon tetap, namun volumenya berubah dan energi panas masuk kedalam masa udara didalam balon.
Apabila panas diberikan kepada sistem (Qin), maka akan berlangsung pengembangan pada zat yang berada didalam sistem. Pengembangan ini akan mengakibatkan piston akan terdorong ke atas (terjadi Wout). Sebab sistem ini tidak mengizinkan adanya keluar masuk massa kedalam sistem (massa selalu konstan) maka sistem ini dinamai control mass.
Suatu sistem bisa menjalani pertukaran panas atau kerja atau keduanya, umumnya dipertimbangkan sebagai sifat pembatasnya:
- Pembatas adiabatik: tidak membiarkan pertukaran panas.
- Pembatas rigid: tidak membiarkan pertukaran kerja.
Dikenal juga istilah dinding, terdapat 2 jenis dinding yakni dinding adiabatik dan dinding diatermik. Dinding adiabatik ialah dinding yang menyebabkan kedua zat mencapai suhu yang sama dalam waktu yang lama (lambat). Untuk dinding adiabatik sempurna tidak memungkinkan berlangsungnya pertukaran kalor antara dua zat. Sementara dinding diatermik ialah dinding yang memungkinkan kedua zat mencapai suhu yang sama dalam waktu yang singkat (cepat).
3. Sistem terisolasi
Sistem yang menyebabkan tidak berlangsungnya pertukaran panas, zat atau kerja dengan lingkungannya. Misalnya : air yang disimpan dalam termos dan tabung gas yang terisolasi. Faktanya, sebuah sistem tidak bisa terisolasi sepenuhnya dari lingkungan, sebab pasti ada terjadi sedikit pencampuran, walaupun hanya penerimaan sedikit penarikan gravitasi. Dalam analisis sistem terasing, energi yang masuk ke sistem sama seperti energi yang keluar dari sistem.
Karakteristik yang menentukan sifat dari sistem dinamai property (koordinat sistem/variabel keadaan sistem), seperti tekanan (p), temperatur (T), volume (v), masa (m), viskositas, konduksi panas dan lain-lain. Selain itu juga terdapat koordinat sistem yang diartikan dari koordinat sistem yang lainnya seperti, berat jenis, volume spesifik, panas jenis dan lain-lain.
Suatu sistem bisa berada pada suatu keadaan yang tidak berubah, jika masing-masing jenis koordinat sistem tersebut bisa diukur pada semua bagiannya dan tidak berbeda nilainya. Keadaan tersebut dinamai sebagai keadaan (state) tertentu dari sistem, dimana sistem memiliki nilai koordinat yang tetap. Jika koordinatnya berubah, maka keadaan sistem tersebut dinamai mengalami perubahan keadaan. Suatu sistem yang tidak mengalami perubahan keadaan dinamai sistem dalam keadaan seimbang (equilibrium).
Hukum Dasar Termodinamika
Terdapat 4 hukum dasar dalam sistem termodinamika, yakni:
- Hukum Awal (Zeroth Law) Termodinamika
Hukum awal mengatakan bahwa dua sistem dalam kondisi setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya. Hukum ini dimasukkan sesudah hukum pertama.
- Hukum Pertama Termodinamika
Hukum yang sama juga terhubung dengan kasus kekekalan energi. Hukum ini mengatakan perubahan energi dalam dari suatu sistem termodinamika tertutup, sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem. Hukum ini bisa diuraikan menjadi beberapa proses, yakni proses dengan Isokhorik, Isotermik, Isobarik, dan juga adiabatik.
- Hukum kedua Termodinamika
Hukum kedua termodinamika terhubung dengan entropi. Tidak ada bunyi untuk hukum kedua termodinamika yang ada hanya pernyataan kenyataan eksperimental yang dijelaskan oleh kelvin-plank dan clausius.
Pernyataan clausius : tidak mungkin suatu sistem apapun bekerja sedemikian rupa maka hasil satu-satunya ialah perpindahan energi sebagai panas dari sistem dengan temperatur tertentu ke sistem dengan temperatur yang lebih tinggi.
Pernyataan kelvin-planck : tidak mungkin suatu sistem bekerja dalam siklus termodinamika dan memberikan sejumlah netto kerja kesekeliling sambil menerima energi panas dari satu reservoir termal.
Total entropi dari suatu sistem termodinamika terasing cenderung untuk meningkat seiring dengan menambahnya waktu, mendekati nilai maksimumnya hal ini dinamai dengan prinsip kenaikan entropi”.
- Hukum ketiga Termodinamika
Hukum ketiga termodinamika terhubung dengan temperatur nol absolut. Hukum ini mengatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti serta entropi sistem akan mendekati nilai minimum. Hukum ini juga mengatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Proses Termodinamika
Proses termodinamika terbagi menjadi 4 jenis, disesuaikan pada keadaan tekanan, volume, dan suhu saat terjadinya proses tersebut. Proses-proses tersebut umumnya digambarkan dalam diagram P-V, yakni diagram yang menggambarkan tekanan (P) dan volume (V) saat proses terjadi. Terdapat 2 hal penting yang harus diingat dari berbagai jenis proses-proses termodinamika, yakni variabel yang berubah dan usaha yang dilakukan. Usaha yang berlangsung pada suatu proses termodinamika bisa diketahui dengan menghitung luasan grafik P-V.
- Isobarik
Isobarik merupakan proses termodinamika yang tidak mengubah nilai tekanan sistem (ΔP = 0). Nilai usaha bisa dihitung dengan persamaan berikut.
![]()
Dari rumus tersebut, diketahui juga jika volume membesar (terjadi pemuaian) maka usaha bernilai positif, dan jika volume mengecil (terjadi penyusutan) maka usaha bernilai negatif.
- Isokhorik
Isokhorik merupakan proses termodinamika yang tidak mengubah nilai volume sistem (ΔV = 0). Pada proses ini, nilai usaha ialah 0 sebab tidak terdapat suatu luasan bangun yang terdapat pada gambar P-V.
- Isotermik
Isotermik merupakan proses termodinamika yang tidak mengubah nilai suhu sistem (ΔT = 0).
Nilai usaha pada proses isotermik dikatakan dengan persamaan sebagai berikut:
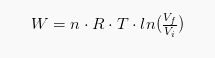
Dimana n ialah jumlah zat yang dikatakan dengan satuan mol, R ialah konstanta gas, dan T adalah suhu. Rumus ini diperoleh dengan menggabungkan persamaan usaha di diagram P-V dengan persamaan gas ideal.
- Adibatik
Adiabatik merupakan proses termodinamika yang tidak mengubah nilai kalor sistem (Q = 0).
Pada gas monoatomic, usaha yang dilakukan pada proses adiabatik bisa dinyatakan dengan persamaan :
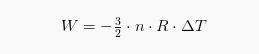
Apabila diperhatikan dengan sekilas, proses adiabatik dan isotermik mempunyai diagram P-V yang serupa. Secara detil, bisa dilihat bahwa proses adiabatik mempunyai kemiringan yang lebih curam dibandingkan proses isotermik
Apabila semua proses tersebut digambarkan menjadi suatu diagram P-V, bisa diperoleh grafik berikut. Patut diingat bahwa satuan-satuan yang digunakan dalam perhitungan ialah Satuan Internasional. Sebagai contoh, satuan untuk suhu yang digunakan ialah Kelvin, satuan untuk volume adalah m3, dan satuan untuk jumlah zat adalah mol.
Demikianlah bahasan kita mengenai termodinamika. Terima kasih bagi yang menyempatkan waktu untuk membaca dan mampir di artikel √ Hukum Termodinamika : Pengertian, Sistem & Prosesnya Lengkap. Semoga bermanfaat dan menambah wawasan kamu ?
Baca Juga Artikel Lainnya
- √ Listrik Statis : Pengertian, Proses, Rumus & Contohnya Lengkap
- √ Sifat- Sifat Cermin : Pengertian, Sejarah & Rumusnya Lengkap
- √ Jenis – Jenis Gelombang : Pengertian, Sifat, Rumus & Contohnya Lengkap
- √ Gelombang Elektromagnetik : Pengertian, Sifat, Spektrum & Manfaatnya Lengkap
- √ Rumus Kalor : Pengertian, Satuan & Teorinya Secara Lengkap