Materi.Co.ID – Hay hay bertemu lagi dengan artikel materi.co.id . Kali ini kita akan membahas tentang atom. Simak ulasan lengkap nya dibawah ini.
Pengertian Atom
Atom merupakan satuan dasar materi, yang terdiri atas inti atom serta awan elektron bermuatan negatif yang mengelilinginya. Inti dari atom terdiri atas proton yang bermuatan positif, dan neutron yang bermuatan netral (kecuali pada inti atom Hidrogen-1, yang tidak mempunyai neutron).
Elektron-elektron di sebuah atom terikat pada inti atom oleh gaya elektromagnetik. Sekumpulan atom bisa berikatan satu sama lainnya, dan membentuk sebuah molekul. Atom yang mengandung jumlah proton dan elektron yang sama yaitu bersifat netral, namun yang mengandung jumlah proton dan elektron yang berbeda sifat positif atau negatif dan disebut sebagai ion. Atom disatukan berdasarkan jumlah proton dan neutron yang terdapat di inti atom tersebut. Jumlah proton pada atom memastikan unsur kimia atom tersebut, serta jumlah neutron menentukan isotop unsur tersebut.
atom berasal dari Bahasa Yunani (ἄτομος/átomos, α-τεμνω), yang di maksud tidak bisa dipotong ataupun sesuatu yang tidak bisa dibagi-bagi lagi. Konsep atom sebagai komponen yang tak bisa dibagi-bagi lagi pertama kali diajukan oleh para filsuf India dan Yunani. Pada saat abad ke-17 dan ke-18, para kimiawan menaruh dasar-dasar pemikiran ini dengan menunjukkan bahwa zat-zat tertentu tidak bisa dibagi-bagi lebih jauh lagi menggunakan metode kimia. Pada akhir abad ke-19 dan awal abad ke-20, para fisikawan berhasil menemukan suatu struktur dan komponen-komponen subatom di dalam atom, melihatkan bahwa ‘atom’ tidaklah bisa dibagi-bagi lagi. Prinsip mekanika kuantum yang di pakai para fisikawan kemudian akan berhasil memodelkan atom.
Pengertian Atom Menurut Para Ahli
- Menurut Leucipus dan Democritus
Menurut Leucipus dan Democritus atom merupakan bagian terkecil dari suatu materi yang tidak bisa dibagi lagi menjadi bagian-bagian tertentu. atom ialah penyusun segala materi yang berada di dunia ini.
- Menurut Dalton
Menurut atom merupakan partikel terkecil dari suatu zat yang tidak bisa diuraikan menjadi partikel yang lebih kecil dengan reaksi kimia biasa.
- Menurut Joseph John Thompson
Menurut Joseph John Thompson Seorang ahli fisika, bahwa ataom merupakan suatu bola yang bermuatan positif dan didalamnya tersebar elektron-elektron seperti kismis.
- Menurut Ernest Rutherford
Menurut Ernest Rutherford Atom merupakan partikel yang terdiri dari inti atom yaitu proton dan neutron yang berada di bagian pusat dan dikelilingi elektron-elektron. Pengertian atom ini ialah hasil dari gabungan seluruh penelitian yang sebelumnya sehingga bersifat ilmiah atau saintifik.
Teori Atom
1.Teori Atom Dalton
Teori atom Dalton merupakan teori mengenai atom yang dikemukakan oleh ilmuwan berkebangsaan Inggris, John Dalton. Pada tahun 1808. Teori atom Dalton ialah teori paling tua mengenai penjelasan tentang atom. Dalton menjelaskan bahwa atom termasuk suatu zat yang tidak bisa dibagi – bagi lagi.
Toeri atom dalton termasuk teori atom pertama yang dikemukakan oleh John Dalton (1808), seorang fisikawan asal Inggris. Dalam mengemukakan teorinya terikat struktur atom yang berdasarkan penelitian yang dikemukakannya dalam A New System of Chemical Philosiphy. Dimana Jogn Dalton menerangkan bahwasanya atom merupakan suatu zat yang tidak bisa dibagi lagi dan merupakan struktur terkecil dari suatu materi.
Hasil penelitian yang dikerjakan oleh John Dalton Mengemukakan Penelitiannya terkait struktur atom sebagai berikut :
- Materi terdiri dari atom yang tidak bisa dibagi lagi.
- Semua atom dari unsur kimia tertentu mempunyai massa dan sifat yang sama.
- Unsur kimia yang berbeda akan mempunyai jenis atom yang berbeda juga.
- Selama reaksi kimia, atom- atom hanya bisa bergabung dan dipecah menjadi atom- atom yang terpisah, tetapi atom tidak bisa dihancurkan dan tidak bisa diubah selama reaksi kimia tersebut.
- Senyawa dibentuk dari unsur- unsurnya melalui penggabungan atom tidak sejenis dengan perbandingan yang sederhana.
2.Teori Atom Thomson
Sesudah teori atom Dalton muncul dan mulai berkembang pada tahun 1903. Hal tersebut menyebabkan para ilmuan lain pun mulai meneliti terkait struktur atom dengan berbagai penerapan dan percobaan setiap peneliti. Salah satunya adalah J.J Thomson.
Hasil penelitian dan penemuan tabung katode oleh William Crookers. Lalu J.J Thomson pun mulai meneliti terkait sinar katode yang dapat menggerakan baling-baling dalam percobaan tabung katode. Dari hasil percobaan tabung katode tersebut bisa dipastikan bahwa sinar katode merupakan salah satu perikel penyusun dalam atom yang bermuatan negatif.
Hasil percobaan dan penelitian terkait struktur atom yang dikerjakan oleh Thomson. Jadi , Thomson pun menyatakan bahwa “Atom ialah bola pejal yang bermuatan positif dan didalamya tersebar muatan negatif elektron”. Yang hasilnya disebut model atom roti kismis.
3. Teori Atom Rutherford
Rutherford dibantu oleh 2 orang muridnya yaitu Hans Geigerden dan Erners Masreden melakukan suatu percobaan yang disebut dengan hamburan sinar alfa di suatu lempengan emas tipis. Saat dilakukan percobaan ini, terlebih dahulu sudah ditemukan partikel alfa yang bersifat positif dan bergerak lurus, serta berdaya tembus besar, sampai dapat menembus lembaran tipis emas.
Hasil penelitian ini, mereka menemukan bahwasanya ketika ditembakkan sinar alfa ke lempengan tipis emas, jadi sebagian partikel alfa akan diteruskan (walaupun penyimpangan sudut kurang dari 1`), namun dari pengamatan Marsden ditemukan kalau satu dari 20.000 partikel alfa dapat membelok dengan sudut 90` atau bahkan lebih.
Ditarik kesimpulan bahwa :
Atom tidak berbentuk bola pejal, dikarenakan hampir semua partikel alfa diteruskan
Jika lempengan emas itu dianggap sebagai lapisan atom-atom emas, maka di dalam atom emas terdapat partikel yang sangat kecil yang bermuatan positif
Partikel positif itu ialah partikel penyusun inti atom, dan ukuran inti atom lebih kecil 10.000 kali dari ukuran atom.
4. Teori Atom Bohr
Pada tahun 1913, seorang ahli fisika bernama Neils Bohr berusaha untuk memperbaiki teori yang dikemukakan oleh Rutherford. Ia mengerjakan sebuah percobaan yang diketahui dengan spectrum atom hydrogen. Dalam percobaan ini, ia berhasil menemukan gambaran mengenai keadaan electron yang menempati daerah inti atom. Teori Bohr menyatukan antara teori mekanika kuantum yang ditemui oleh Planck dengan teori Rutherford yang dikemukakan oleh Rutherford. Lalu, Bohr mengungkapkan 4 postulatnya, yaitu :
- Hanya seperangkat orbit tertentu yang dapat dibagi satu electron dalam satu atom hydrogen. Orbit ini disebut dengan orbit stationer (menetap) electron dan merupakan lintasan melingkar di sekeliling inti.
- Saat electron berada di lintasan stationer, energi elektorn akan tetap sampai dan tidak ada energi dalam bentuk radiasi yang dipancarkan.
- Elektron bisa berpindah dari satu lintasan stationer ke lintasan stationer yang lain. Perpindahan ini juga bisa memakan energi sesuai dengan persamaan Plank E2-E1 =hf
- Lintasan stationer mempunyai besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut.
Bohr mengungkapkan bahwa electron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut kulit electron atau kulit energi. Tingkat eneri yang paling rendah ialah kulit electron yang paling dalam, dan semakin besar nomor kulitnya, jadi semakin besar tingkat energinya.
Model Atom
1. Model Atom Dalto
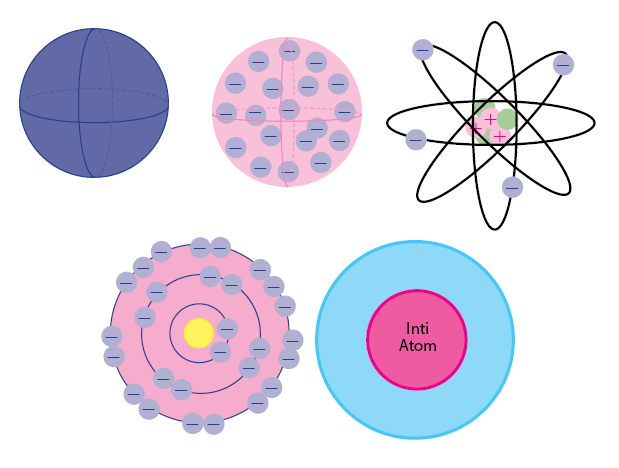
Model atom yang sederhana yaitu model atom dalton, yang sudah dikemukakan oleh John Dalton, seorang ilmuwan asal kebangsaan Inggris. Menurut model atom ini, atom ialah bola pejal yang tidak memunyai muatan.
Lalu, menurut teori atom ini, atom yaitu kesatuan terkecil yang bisa dibagi-bagi lagi. Apabila unsur kimia yang berbeda akan mempunyai jenis atom yang berbeda-beda juga.
2. Model Atom Thompson
Model atom yang kedua yaitu model atom Thompson. Sesuai dengan namanya, model atom satu ini ditemukakan oleh Joseph John Thompson. Model atom Thompson mempunyai bentuk seperti roti kismis.
Hal itu dikarenakan atom ialah suatu bola padat yang bermuatan positif pada partikel negatif (elektron) yang tersebar didalamnya. Lalu, muatan positif dan negatif yang berada pada atom tersebut jumlahnya sama. Model atom ini telah diakui pada penelitian Thomson yang memakai sinar tabung katoda.
3. Model Atom Rutherford
Model atom Rutherford telah ditemukakan oleh Ernest Rutherford di tahun 1911. Di teori atom ini, setiap atom memiliki kandungan inti atom yang bermuatan positif pada elektron yang mengelilingi di dalamnya.
Lalu, massa atom ini terpusat pada inti atom dan sebagian besar volume atom ini yaitu ruang hampa, Karena telah diakui dari hasil percobaan penembakan logam dari sinar alpha, yang dikenal sebagai Percobaan Geiger-Marsden.
4. Model Atom Bohr
Model atom Bohr ditemukakan oleh Niels Bohr dan Ernest Rutherford di tahun 1913. Di model atom Bohr merupakan bahwa atom terdiri berdasarkan pada inti atom yang memiliki kandungan proton dan neutron kemudian dikelilingi oleh elektron yang berputar di orbitnya (tingkat energi tertentu). Orbit disebut juga sebagai kulit atom.
5. Model Atom Mekanika Kuantum
Model atom mekanika kuantum merupakan model atom yang sangat modern sekali. Atom ini berdasarkan pada inti atom bermuatan positif dan awan-awan elektron yang mengelilinginya. Ditemukannya elektron yang diberi nama orbital. Pada teori ini, ada 4 jenis orbital yakni s, p, d, f.
Partikel Dasar Atom
- Proton
Proton merupakan partikel dasar yang mempunyai muatan positif (+1) dan mempunyai diameter hanya 1/3 diameter electron. Namun, proton mempunyai massa sekitar 1840 kali electron.
- Neutron
Neutron merupakan partikel dasar yang tidak mempunyai muatan (netral), dan memiliki massa yang sama dengan gabungan antara massa proton dan massa electron.
- Elektron
Elektron merupakan partikel dasar yang memiliki muatan negative (-1) dan mempunyai massa paling ringan diantara partikel lainnya yang hanya 1/1840 kali massa proton atau neutron.
Partikel – Partikel Atom
- Partikel Subatom
Definisi atom menjelaskan bahwa atom merupakan bagian terkecil dari material yang tidak bisa dibagi lagi, tetapi dalam ilmu modern, atom sendiri tersusun dari beberapa partikel subatom. Partikel subatom tersebut meliputi proton, elektron dan neutron.
- Inti Atom
Inti atom terdapat atas proton dan neutron yang terkait di inti atom oleh suatu gaya elektromagnetik. Proton dan nutron ini dinamakan nucleon atau penyusun inti.
Inti atom mempunyai diameter sekitar 10-15 nm. Atom dari unsur kimia yang sama mempunyai jumlah proton yang sama juga. Suatu unsur bisa memiliki variasi jumlah neutron yang disebut isotop.
- Awan Elektron
Awan partikel merupakan suatu daerah dalam sumur potensi dimana tiap-tiap electron mendapatkan sejenis gelombang diam (gelombang yang tidak bergerak).
Sifat – Sifat Atom
- Sifat Nuklir
Sifat nuklir (radioaktif) ini hanya dipunyai oleh unsur-unsur atom yang mempunyaii nomor atom lebih dari 82. Dari sekitar 339 nuklida yang sudah ditemui secara alami di dalam bumi, sebanyak 269 diantaranya belum terpantau secara menyeluruh.
Pada unsur kima, 80 dari unsur yang telah diketahui mempunyai satu atau lebih isotope stabil. Unsur 43, 63, dan semua unsur yang mempunyai nomor atom lebih dari 82 ini tidak memunyai isotope stabil. Hal inilah yang dapat mengakibatkan unsur tersebut mempunyai sifat radioaktif.
- Massa Atom
Jumlah semua dari partikel dasar dalam suatu atom dapat disebut juga dengan nomor massa. Massa atom dalam kondisi diam ini dinilai dengan menggunakan satuan Dalton.
Massa atom dalam unsur yang berbeda ini mempunyai massa yang bervariasi. Massa tersebut tergantung pada jumlah suatu proton dan neutron dalam intinya. Semakin besar massa atom akan semakin kecillah atom tersebut.
- Nomor Atom
Atom-atom dalam zat yang berbeda ini mempunyai jumlah proton yang tidak sama dalam intinya. Jumlah proton dalam inti ini disebut juga dengan nomor atom.
- Gaya Atom
Gaya elektromagnetik ini menjaga elektron yang bersifat muatan negatif agar tetap berada orbit sekeliling inti muatan positif. Terdiri gaya tarik inti yang merupakan suatu gaya paling kuat menjaga proton dan neutron tetap berada dalam inti atom. Gaya inti seratus kali lebih kuat dari pada suatu gaya elektromagnetik.
Demikianlah bahasan kita mengenai atom. Terima kasih bagi yang menyempatkan waktu untuk membaca dan mampir di artikel √ Teori Atom : Pengertian, Model, Partikel & Sifatnya Lengkap. Semoga bermanfaat dan menambah wawasan kamu ?
Baca Juga Artikel Lainnya
- √ Prinsip Kromatografi : Pengertian & Jenisnya Lengkap
- √ Sifat – Sifat Polimer : Pengertian, Jenis & Reaksinya Lengkap
- √ Ciri – Ciri Ikatan Ion : Pengertian, Sifat & Pembentukannya Lengkap
- √ Jenis – Jenis Larutan : Pengertian, Jenis, Kadar & Reaksinya Lengkap
- √ Bahaya Kloroform : Pengertian, Reaksi & Penggunaannya Lengkap