Materi.Co.ID – Hay hay bertemu lagi dengan artikel materi.co.id . Kali ini kita akan membahas tentang sifat koligatif larutan. Simak ulasan lengkap nya dibawah ini.
Pengertian Sifat Koligatif Larutan
Sifat koligatif merupakan sifat-sifat yang hanya bergantung kepada jumlah atau kuantitas sebuah partikel zat yang terlarut didalam larutan, dan tidak bergantung pada identitas atau jenis partikel zat terlarut, tidak butuh apapun yang berada didalam zat terlarut itu meskipun berbentuk molekul, ion, ataupun atom, sifat koligatif ini hanya melihat dari sisi kuantitas bukan dari segi kualitas.
Sebenarnya sifat larutan itu sama seperti kekentalan ( viskositas ), rasa, dan juga warna yang sering dijumpai dalam kehidupan sehari-hari, dan contoh simple seperti terasi yang sering digunakan untuk memasak ataupun garam dapur (NaCI) yang cukup mudah untuk ditemui di dapur.
konsentrasi zat terlarut itu bisa dikelompokkan menjadi 4 besaran, yakni:
1. Molaritas
Molaritas merupakan jumlah mol zat terlarut dalam setiap 1 liter larutan. Satuan dari molaritas dinyatakan dalam mol dm3 atau mol L-1, dilambangkan M. Rumus untuk molaritas ini bisa diformulasikan sebagai berikut:
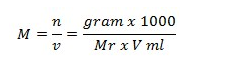
Keterangan:
- M = molaritas suatu zat (mol/L)
- gr = massa suatu zat (gram)
- Mr = massa molekul relatif suatu zat (gr/mol)
- V = volume larutan (ml)
2. Molalitas
Molalitas merupakan konsentrasi larutan yang mengatakan jumlah mol zat terlarut dalam 1 kg atau 1000 gram pelarut dilambangkan m. Rumus untuk molalitas ini bisa diformulasikan sebagai berikut:
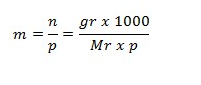 Keterangan:
Keterangan:
- m = molalitas suatu zat (molal)
- n = mol suatu zat (mol)
- p = massa pelarut (gr)
3. Fraksi mol
Fraksi mol merupakan ukuran konsentrasi larutan yang mengatakan perbandingan jumlah mol sebagian zat pada jumlah mol total komponen larutan dengan lambang X.
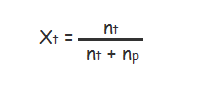 Keterangan :
Keterangan :
- Xt : Fraksi mol zat terlarut
- Np : Jumlah mol zat pelarut
- Nt : Jumlah mol zat terlarut
4. Normalitas
Normalitas merupakan besaran yang mengatakan jumlah mol ekuivalen dari zat yang terlarut dalam setiap satuan volume larutan dilambangkan N. Rumus untuk normalitas ini bisa diformulasikan sebagai berikut:
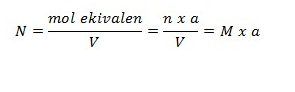 Keterangan:
Keterangan:
- N = normalitas ( mol ek/L)
- n = mol suatu zat (mol)
- a = ekivalen suatu zat
- V = volume larutan (liter)
Sifat Koligatif Larutan Nonelektrolit
1. Penurunan Tekanan Uap
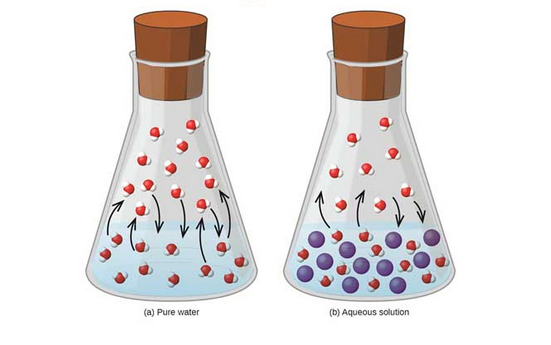
Apabila zat terlarut bersifat non-volatil (tidak mudah menguap, tekanan uapnya tidak bisa terukur), tekanan uap dari larutan akan selalu lebih rendah dari tekanan uap pelarut murni yang volatil. Idealnya, tekanan uap dari pelarut volatil di atas larutan yang terkandung zat terlarut non-volatil berbanding lurus terhadap konsentrasi pelarut dalam larutan.

Contohnya :
- Mendapatkan Benzena Murni
Bahan bakar untuk pesawat terbang bernama avgas (aviation gasoline) atau yang lebih dikenal dengan bensol. Nama lain dari bensol ialah benzena. Benzena ialah kandungan alami dalam minyak bumi. Benzena umumnya tercampur dengan toluena yang membentuk larutan benzena-toluena. Bagaimana memperoleh benzena murni jika larutan yang terdiri atas benzena dan toluena yang mempunyai fraksi mol yang sama? Untuk memperoleh benzena murni menggunakan pemisahan campuran dengan distilasi bertingkat, dengan mengguakan prinsip berbedaan tekanan uap antara zat pelarut dengan zat terlarut.
2. Kenaikan Titik Didih
Titik didih zat cair merupakan suhu tetap pada saat zat cair mendidih. Di suhu ini, tekanan uap zat cair sama seperti tekanan udara di sekitarnya. Hal ini mengakibatkan terjadinya penguapan di seluruh bagian zat cair. Titik didih zat cair bisa diukur pada tekanan 1 atmosfer. Dari hasil penelitian, ternyata titik didih larutan selalu lebih tinggi daripada titik didih pelarut murninya. Hal ini dikarenakan adanya partikel – partikel zat terlarut dalam suatu larutan menghalangi peristiwa penguapan partikel pelarut. Oleh sebab itu, penguapan partikel – partikel pelarut memerlukan energi yang lebih besar. Perbedaan titik didih larutan dengan titik didih pelarut murni dinamaiii kenaikan titik didih yang dinyatakan dengan

Contohnya :
- Air mendidih
Air yang mendidih pada 100 °C pada tekanan 1 atm. Apabila air tersebut ditambahkan dengan garam maka titik didihnya menjadi lebih dari 100 °C pada tekanan yang sama. Itu berarti air pada larutan garam mengalami kenaikan titik didih. Kenaikan titik didih larutan garam ini disesuaikan dari konsentrasi garam di dalam air, semakin banyak kandungan garam maka kenaikan titik didihnya makin tinggi.
3. Penurunan Titik Beku
Pada larutan dengan pelarut volatil dan zat terlarut non-volatil, hanya partikel-partikel pelarut yang bisa menguap dari larutan maka meninggalkan partikel-partikel zat terlarut. Hal serupa juga berlangsung dalam banyak kasus di mana hanya partikel-partikel pelarut yang memadat (membeku), meninggalkan partikel-partikel zat terlarut membangun larutan yang konsentrasinya lebih pekat. Titik beku dari suatu larutan ialah temperatur di mana tekanan uap larutan sama dengan tekanan uap pelarut murni. Pada temperatur ini, 2 fasa – pelarut padat dan larutan cair – berada dalam kesetimbangan.
Adanya zat terlarut dalam larutan akan menyebabkan titik beku larutan lebih kecil dibandingkan titik beku pelarutnya. Persamaannya dapat ditulis sebagai berikut

Contohnya :
- Membuat Campuran Pendingin pada Es Putar
Untuk membuat es putar dibutuhkan yang namanya cairan pendingin. Cairan pendingin merupakan larutan berair yang mempunyai titik beku jauh di bawah 0°C. Secara sederhana, cairan pendingin dibuat dengan melarutkan berbagai jenis garam ke kepingan es batu. Pada pembuatan es putar cairan pendingin dibuat dengan cara mencampurkan garam dapur dengan kepingan es batu dalam sebuah bejana berlapis kayu. Pada saat pencampuran itu, es batu akan mencair dan suhu campuran turun. Sedangkan, campuran bahan pembuat es putar dimasukkan dalam bejana lain yang terbuat dari bahan stainless steel. Bejana ini selanjutnya dimasukkan ke dalam cairan pendingin, sambil terus-menerus diaduk sehingga campuran membeku.
4. Tekanan Osmotik
Tekanan Osmotik merupakan gaya yang sangat dibutuhkan untuk menyeimbangkan desakan Zat Pelarut yang melalui selaput Semipermiabel ke dalam suatu larutan.
Membran Semipermeabel ialah sebuah selaput yang bisa dilewati oleh molekul – molekul pelarut namun tidak bisa dilalui oleh Zat terlarut.
Rumus tekanan osmotik ialah :
II = M x R x T
- II = tekanan osmotik
- M = molaritas larutan
- R = tetapan gas (0,082)
- T = suhu mutlak
Contohnya :
- Mesin Cuci Darah
Pasien penderita gagal ginjal harus menjalani terapi cuci darah (hemodialisis) dengan menggunakan mesin dialisis. Mesin mesin dialisis ini memakai prinsip tekanan osmosis larutan. Terapi pada hemodialisis menggunakan metode dialisis, yakni proses perpindahan molekul kecil-kecil seperti urea dari dalam sel darah melalui membran semipermeabel dan masuk ke cairan lain, selanjutnya dibuang. Membran tak bisa ditembus oleh molekul besar seperti protein maka akan tetap berada di dalam darah.
Sifat Koligatif Larutan Elektrolit
Sifat Koligatif Larutan Elektrolit memiliki nilai yang lebih besar dibandingkan dengan Sifat Koligatif Larutan Non-Elektrolit.
Dari banyaknya Partikel Zat yang terlarut dari hasil Reaksi Ionisasi, maka bisa simpulkan larutan Elektrolit yang dirumuskan dalam faktor Van’t Hoff yaitu, setiap Perhitungan Sifat Koligatif Larutan Elektrolit selalu dikalikan dengan faktor Van’t Hoff:
i = 1 + (n – 1) α
Keterangan :
- i = faktor Van’t Hoff
- n = jumlah koefisien
- α = derajat ionisasi
1. Penurunan Tekanan Uap Jenuh
Penurunan Tekanan Uap Jenuh dengan memakai faktor Van’t Hoff dapat di rumuskan sebagai berikut :
- Δ P = Po x Xterlarut x i
2. Kenaikan Titik Didih
Kenaikan Titik Didih dapat di tulis persamaannya sebagai berikut :
- ΔTb = kb x m x i
3. Penurunan Titik Beku
Rumus Persamaannya adalah :
- ΔTf = kf x m x i
4. Tekanan Osmotik
Rumus Persamaannya adalah :
- π = M x R x T x i
Demikianlah bahasan kita mengenai sifat koligatif larutan. Terima kasih bagi yang menyempatkan waktu untuk membaca dan mampir di artikel √ Sifat Koligatif Larutan : Pengertian, Sifat, Rumus & Contohnya Lengkap. Semoga bermanfaat dan menambah wawasan kamu ?
Baca Juga Artikel Lainnya
- √ Bahaya Kloroform : Pengertian, Reaksi & Penggunaannya Lengkap
- √ Prinsip Kromatografi : Pengertian & Jenisnya Lengkap
- √ Ciri – Ciri Ikatan Ion : Pengertian, Sifat & Pembentukannya Lengkap
- √ Jenis – Jenis Larutan : Pengertian, Jenis, Kadar & Reaksinya Lengkap
- √ Kegunaan Logam Alkali : Pengertian & Sifatnya Lengkap